materiales para laboratorio de química
tubos de ensayo
Los tubos de ensayo están disponibles en una multitud de tamaños, comúnmente de 1 a 2 cm de ancho y de 5 a 20 cm de largo.
Vasos de precipitado.
Pueden ser de dos formas: altos o bajos. Sin graduar o graduados y nos dan un volumen aproximado (los vasos al tener mucha anchura nunca dan volúmenes precisos). Se pueden calentar (pero no directamente a la llama) con ayuda de una rejilla.
Desecador.
Recipiente de vidrio que se utiliza para evitar que los solutos tomen humedad ambiental. En (2), donde hay una placa, se coloca el soluto y en (1) un deshidratante.

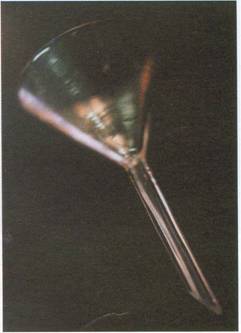
Embudo de vidrio
Se emplea para trasvasar líquidos o disoluciones de un recipiente a otro y también para filtrar, en este caso se coloca un filtro de papel cónico o plegado.
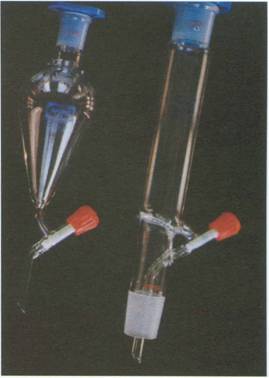
Buchner y Kitasato
El Buchner es un embudo de porcelana, tiene una placa filtrante de agujeros grandes por lo que se necesita colocar un papel de filtro circular, que acople perfectamente, para su uso. Se emplea para filtrar a presión reducida. Su uso va unido al Kitasato, recipiente de vidrio con rama lateral para conectar con la bomba de vacío (normalmente, una trompa de agua).

Cristalizador

Embudos de decantación
Son de vidrio. Pueden ser cónicos o cilíndricos. Con llave de vidrio o de teflón. Se utilizan para separar líquidos, inmiscibles, de diferente densidad.
Probeta
Recipiente de vidrio para medir volúmenes, su precisión es bastante aceptable, aunque por debajo de la pipeta. Las hay de capacidades muy diferentes: 10, 25, 50 y 100 ml.
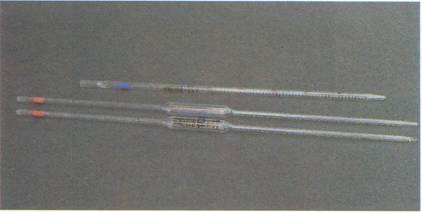
Pipetas
Recipientes de vidrio para medir volúmenes, son de gran precisión. Las hay de capacidades muy diferentes: 0'1, 1'0, 2'0, 5'0, 10'0.............. ml (las más precisas miden μI). En cuanto a la forma de medir el volumen, podemos distinguir entre:graduadas: sirven para poder medir cualquier volumen inferior al de su máxima capacidad; de enrase (sólo sirven para medir el volumen que se indica en la pipeta): a su vez pueden ser simples o dobles. La capacidad que se indica en una pipeta de enrase simple comprende desde el enrase marcado en el estrechamiento superior hasta el extremo inferior. En una pipeta de enrase doble, la capacidad queda enmarcada entre las dos señales.
Si el líquido no ofrece peligrosidad, colocando la boca en la parte superior de la pipeta, se succiona y se hace subir el líquido un poco por encima del enrase. La pipeta se cierra con el dedo índice.
Buretas
Material de vidrio para medir volúmenes con toda precisión. Se emplea, especialmente, para valoraciones. La llave sirve para regular el líquido de salida. Manejo: 1) se llena con la ayuda de un embudo. 2) los líquidos han de estar a la temperatura ambiente. 3) el enrase debe hacerse con la bureta llena (aunque también se puede enrasar a cualquier división), tomando como indicador la parte baja del menisco. 4) la zona que hay entre la llave y la boca de salida debe quedar completamente llena de líquido.
Pueden ser: a) rectas. b) con depósito. c) de sobremesa con enrase automático.
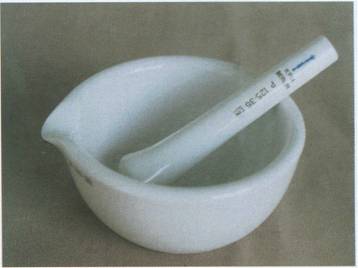
Mortero con mano o mazo
Pueden ser de vidrio, ágata o porcelana. Se utilizan para triturar sólidos hasta volverlos polvo, también para triturar vegetales, añadir un disolvente adecuado y posteriormente extraer los pigmentos, etc.
Gradilla
Material de madera o metal (aluminio), con taladros en los cuales se introducen los tubos de ensayo.
Escobilla y escobillón
Material fabricado con mechón de pelo natural, según el diámetro se utilizan para lavar: tubos de ensayo, buretas, vasos de precipitado, erlenmeyer, etc.

Erlenmeyer
Matraz de vidrio donde se pueden agitar disoluciones, calentarlas (usando rejillas), etc. Las graduaciones sirven para tener un volumen aproximado. En una valoración es el recipiente sobre el cual se vacía la bureta.

Matraz
Instrumento de laboratorio que se utiliza, sobre todo, para contener y medir líquidos. Es un recipiente de vidrio de forma esférica o troncocónica con un cuello cilíndrico.
bibliografia:





.png)

